?
?????????????????????????????????????????? 2020版《中國藥典》今日開始實施
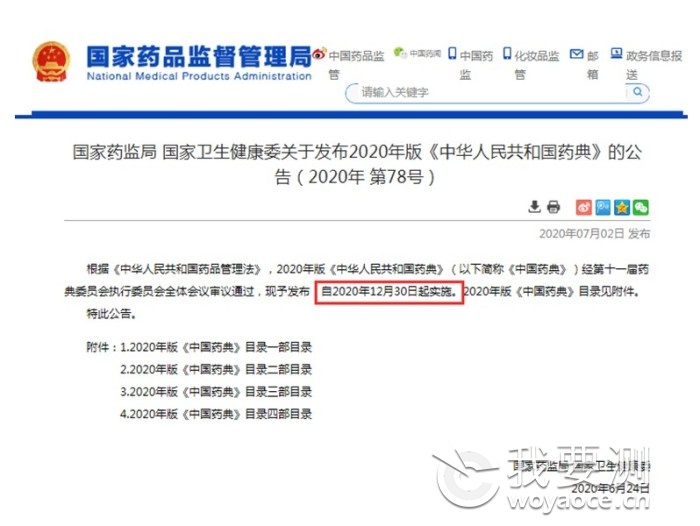
????? 7月2日�����,國家藥品監(jiān)督管理局�、國家衛(wèi)生健康委發(fā)布公告�,正式頒布2020年版《中華人民共和國藥典》(以下簡稱《藥典》),并于今日實施��。新版《藥典》共收載品種5911種���,新增319種���,修訂3177種,不再收載10種�,品種調(diào)整合并4種。穿山甲���、馬兜鈴��、天仙藤����、黃連羊肝丸等未被繼續(xù)收載。

??? 《中國藥典》是由國家藥典委員會創(chuàng)作的�,用于保證藥品質(zhì)量可控、確保人民用藥安全有效的藥品法典���。作為國家藥品標準體系的核心,藥典涵蓋了基本藥物���、醫(yī)療保險目錄品種和臨床常用藥品���,其設(shè)置使得藥品研制、生產(chǎn)�、經(jīng)營、使用和管理各環(huán)節(jié)實現(xiàn)了有法可依�、有法必依,嚴格的法定依據(jù)也加強了對藥品安全性和有效性的控制����。
新版《藥典》的實施將對整體提升我國藥品標準水平,提高藥品質(zhì)量����,保證公眾用藥安全有效���,促進醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展發(fā)揮重要作用。
????????? 2020年版藥典編制工作基本達到了編制大綱設(shè)立的各項既定目標:
????? 第一���,適度增加了收載品種����,收載總數(shù)達到5911種��,穩(wěn)步提高了藥典收載的品種數(shù)量�����;
????? 第二����,基本完成了國家藥品標準清理工作,其中涉及化學(xué)藥6263個品種�、中成藥9585個品種、飲片藥材1252個品種���、中藥提取物9個品種�、生物制品373個品種,為完善標準提高和淘汰機制奠定了堅實的基礎(chǔ)����;
????? 第三,以實施“兩法兩條例”為契機��,全面�、系統(tǒng)地完善了藥典的標準體系,貫徹了藥品質(zhì)量全程管理理念��,提高了橫向覆蓋中藥���、化學(xué)藥、生物制品����、原料藥、藥用輔料���、藥包材以及標準物質(zhì)的質(zhì)量控制技術(shù)規(guī)范����、要求���,完善了縱向涵蓋藥典凡例��、制劑通則�、檢驗方法以及指導(dǎo)原則的制修訂,加強了涉及藥品研發(fā)����、生產(chǎn)、質(zhì)控�����、流通和使用等環(huán)節(jié)的通用技術(shù)要求體系的建設(shè)���;
????? 第四����,強化了《中國藥典》的規(guī)范性�����,使藥典各部之間更加的協(xié)調(diào)��、統(tǒng)一���。建立并完善了統(tǒng)一規(guī)范的藥品�����、藥用輔料以及藥包材通用名稱命名原則��,加強了通用技術(shù)要求與品種標準內(nèi)容的統(tǒng)一��;
????? 第五����,加強藥典通用技術(shù)要求,重點完善了藥品安全性和有效性的控制要求����,實現(xiàn)了“中藥標準繼續(xù)主導(dǎo)國際標準制定�,化學(xué)藥、藥用輔料標準基本達到或接近國際標準水平�,生物制品標準緊跟科技發(fā)展前沿,與國際先進水平基本保持一致”的總目標�;
????? 第六,加強了藥典機構(gòu)間的國際交流與合作�,促進了與藥典的協(xié)調(diào)統(tǒng)一,擴大了《中國藥典》的國際影響力����。
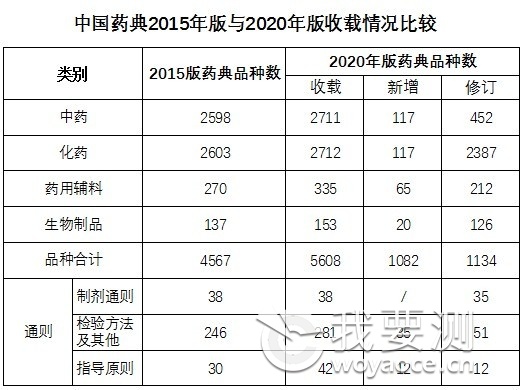
新版藥典新增319種�����,修訂3177種�,不再收載10種�,品種調(diào)整合并4種,共收載品種5911種�。一部中藥收載2711種,其中新增117種�����、修訂452種���。二部化學(xué)藥收載2712種����,其中新增117種�、修訂2387種。三部生物制品收載153種����,其中新增20種�����、修訂126種��;新增生物制品通則2個�����、總論4個��。四部收載通用技術(shù)要求361個�����,其中制劑通則38個(修訂35個)�����、檢測方法及其他通則281個(新增35個、修訂51個)���、指導(dǎo)原則42個(新增12個�����、修訂12個)����;藥用輔料收載335種,其中新增65種�、修訂212種(見表1 )
????????????????????????????????????? 表1 中國藥典2020年版收載情況比較
新版藥典的特點
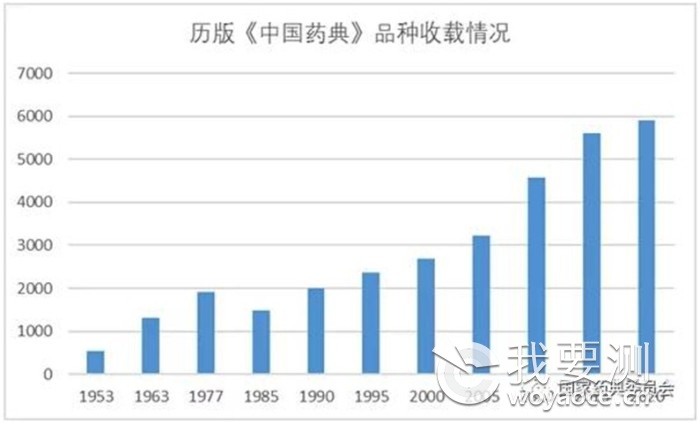
????? 1.穩(wěn)步推進藥典品種收載
與5.5%。品種收載堅持以臨床需求為導(dǎo)向��,進一步擴大了國家基本藥物目錄和國家基本醫(yī)療保險用藥目錄品種的收載���,使臨床常用藥品的質(zhì)量得到了可靠保障�����。
?????????????????????????????? 表2 1953-2020年版《中國藥典》收載品種數(shù)量情況表
????? 2.藥典標準體系進一步完善
???? 2020年版藥典編制工作以建立科學(xué)�、全面��、可檢驗���、能執(zhí)行的標準體系為重點��,構(gòu)建并完善了以凡例為基本要求�、通則為總體規(guī)定����、指導(dǎo)原則為技術(shù)引導(dǎo)�����、品種正文為具體要求的藥典架構(gòu)���,不斷健全以《中國藥典》為核心的國家藥品標準體系。同時���,通過加強對藥典相關(guān)通用技術(shù)要求和正文具體內(nèi)容的制修訂����,從整體上提升了我國藥品的標準水平��,推進了我國上市藥品質(zhì)量的進一步提升��。
????? 3.成熟分析檢測技術(shù)應(yīng)用進一步擴大
??? 新版藥典對標國際��,緊跟國際前沿���,借鑒國際先進標準經(jīng)驗,不斷擴大成熟檢測技術(shù)在藥品質(zhì)量控制中的應(yīng)用�,進一步提高檢測方法的靈敏度����、專屬性���、適用性和可靠性�,對加強藥品質(zhì)量控制���,保障藥品質(zhì)量�,提升藥品監(jiān)管能力發(fā)揮了重要作用���。
???? 4.藥品安全性控制要求不斷加強??
??? 在中藥方面:加強對中藥材(飲片)33種禁用農(nóng)殘的控制���,加強對中藥材(飲片)真菌毒素、中藥內(nèi)源性毒性成分藥材的質(zhì)量控制���,完善了《中藥有害殘留物限量制定指導(dǎo)原則》���。
??? 在化學(xué)藥方面:加強藥品雜質(zhì)控制,對可能引入基因毒性雜質(zhì)部分產(chǎn)品在生產(chǎn)要求項目之下增訂工藝的評估要求���,重點加強高風(fēng)險制劑涉及安全性控制項目的要求�,修訂并規(guī)范了相關(guān)品種無菌和微生物限度要求。
??? 在生物制品方面:加強了對病毒安全性控制����,新增氫氧化鋁佐劑質(zhì)量控制通則提升了疫苗佐劑質(zhì)量,明確了原液合批����、防腐劑及抗生素使用的相關(guān)原則,增訂重組生物技術(shù)產(chǎn)品相關(guān)蛋白雜質(zhì)的控制和限度���。
???? 5.藥品有效性控制不斷完善
???? 在中藥方面:建立了顯微檢查法����、薄層色譜法����、高效液相色譜法、聚合酶鏈式反應(yīng)(PCR)法以及核酸序列檢測法等一系列中藥材(飲片)鑒別方法����;基于研究建立了與臨床療效相關(guān)的成分含量控制;以質(zhì)量為標的制定成分限量標準��;建立專屬性高的指標成分控制項目。
??? 在化學(xué)藥方面:完善藥品制劑的有效性指標項目����,進一步完善口服固體制劑溶出度檢測方法��,加強與放射性藥品活性相關(guān)的檢查方法的研究和增訂�����。
??? 在生物制品方面:增訂了人用聚乙二醇化重組蛋白及多肽制品��、螨變應(yīng)原制品和人用基因治療制品總論等����,重組類治療生物制品增訂了相關(guān)蛋白檢測及限度要求等。
??? 6.全過程質(zhì)量控制體系逐步構(gòu)建
??? 進一步加強了涉及藥品研發(fā)����、生產(chǎn)、檢測��、運輸��、包裝����、貯藏等可能影響藥品質(zhì)量環(huán)節(jié)的相關(guān)指導(dǎo)原則的制定��,逐步構(gòu)建全過程質(zhì)量控制體系���。完善了滅菌工藝驗證、環(huán)境檢測等相關(guān)技術(shù)要求����,修訂了非無菌藥品微生物限度標準、藥品潔凈實驗室微生物監(jiān)測和控制指導(dǎo)原則���、無菌檢查用隔離系統(tǒng)驗證指導(dǎo)原則�、藥品微生物實驗室質(zhì)量管理指導(dǎo)原則�。
??? 通過對注射劑生產(chǎn)過程中無菌保障體系的評估與調(diào)查,增訂了滅菌用生物指示劑指導(dǎo)原則���、生物指示劑耐受性檢查法指導(dǎo)原則��,并系統(tǒng)修訂了滅菌法���,明確企業(yè)對控制生產(chǎn)過程中的微生物污染承擔主體責任。對制劑通則整體框架進行較系統(tǒng)的增修訂�,為控制和保證制劑生產(chǎn)的”�����,特別明確了”要求����,以體現(xiàn)制劑全過程控制的理念���;提出了”概念,引導(dǎo)藥品生產(chǎn)企業(yè)根據(jù)產(chǎn)品自身穩(wěn)定性進行前瞻性的質(zhì)量考察���;對”的體例及內(nèi)容進行了統(tǒng)一��,即按照:原輔料工藝與技術(shù)質(zhì)量與控制包裝與使用貯存與運輸?shù)任鍌€方面的技術(shù)要點做出規(guī)范���,對相關(guān)劑型增訂了工藝控制技術(shù)要求。
??? 7.輔料標準水平進一步提升
??? 進一步增加制劑生產(chǎn)常用藥用輔料標準的收載��,貫徹原輔包關(guān)聯(lián)審評審批制度質(zhì)量控制理念��,不斷健全藥用輔料國家標準體系����,加強藥用輔料自身安全性控制���,基于輔料雜質(zhì)或自身降解產(chǎn)物可能對制劑安全性和穩(wěn)定性產(chǎn)生的影響,建立相應(yīng)的控制項目和限度標準���,完善輔料相關(guān)功能性控制項目的設(shè)立�����、評價方法的建立以及限度標準的制定�����。
??? 8.國際標準協(xié)調(diào)進一步加強
??? 加強與國外藥典的比對研究����,注重國際成熟技術(shù)標準的借鑒和轉(zhuǎn)化�����,不斷推進與各國藥典標準的協(xié)調(diào)�。參考人用藥品注冊技術(shù)要求國際協(xié)調(diào)會(ICH相關(guān)指導(dǎo)原則在《中國藥典》的轉(zhuǎn)化實施。
??? 9.藥典導(dǎo)向作用進一步強化
??? 緊跟國際藥品標準發(fā)展的趨勢�����,兼顧我國藥品生產(chǎn)的實際狀況,在藥品監(jiān)管理念���、質(zhì)量控制要求�、檢測技術(shù)應(yīng)用�����、工藝過程控制���、產(chǎn)品研發(fā)指導(dǎo)等方面不斷加強。在檢測項目和限度標準設(shè)置方面���,既考慮保障藥品安全的底線����,又充分關(guān)注臨床用藥的可及性���,進一步強化藥典對藥品質(zhì)量控制的導(dǎo)向作用��。
河北省中藥材檢測中心各中心逐步完成體系改版工作�����,力爭為客戶提供藥典換版無縫銜接�����。我們秉承“數(shù)字本草”的職業(yè)精神����,堅持 所以精準“公正、科學(xué)�����、準確��、滿意����、改進的質(zhì)量方針,構(gòu)建第三方檢測服務(wù)平臺�����,為客戶提供客觀公正�、準確高效的全程化、一站式檢驗服務(wù),從田間地頭��、倉儲物流到醫(yī)院藥房等各環(huán)節(jié)的全產(chǎn)業(yè)鏈科研定制與檢驗檢測服務(wù)����,以追溯全程化、檢驗可視化�����、信息數(shù)字化的質(zhì)量檢測服務(wù)市場��,提升客戶價值�����。
參考資料:
1����、國家藥監(jiān)局 國家衛(wèi)生健康委關(guān)于發(fā)布2020年版《中華人民共和國藥典》的公告(2020年 第78號)——國家藥品監(jiān)督管理局
2����、剛剛!新版藥典正式公布�����,影響所有中藥企業(yè)——賽柏藍
3、正式頒布��!2020年版《中國藥典》來了����,12月30日起正式實施——中國醫(yī)藥報
4、2020版《中國藥典》正式頒布�����!12月30日起實施�����!——搜狐新聞
5�����、2020年版《中華人民共和國藥典》���,來了���!——騰訊新聞-基源醫(yī)學(xué)在線
?