1. 全國9批中藥材及中藥飲片檢出金胺O
23日�,國家食品藥品監(jiān)督管理總局在其官網(wǎng)發(fā)布通告稱,近期�����,食品藥品監(jiān)管總局在全國范圍內(nèi)組織對(duì)黃柏���、延胡索等中藥材及中藥飲片進(jìn)行了專項(xiàng)監(jiān)督抽驗(yàn)���,分別從藥品生產(chǎn)、經(jīng)營和使用環(huán)節(jié)進(jìn)行了抽樣�,檢出9批不合格。
通告中指出����,經(jīng)重慶市食品藥品檢驗(yàn)檢測研究院檢驗(yàn),發(fā)現(xiàn)標(biāo)示為安國市萬聯(lián)中藥飲片有限公司��、安徽易元堂中藥飲片科技有限公司、安徽滬昆中藥飲片有限公司��、亳州市長生中藥飲片有限公司��、亳州市貢藥飲片廠��、國藥控股廣西中藥飲片有限公司6家藥品生產(chǎn)企業(yè)生產(chǎn)的7批黃柏檢出金胺O;經(jīng)廣州市藥品檢驗(yàn)所檢驗(yàn)�����,發(fā)現(xiàn)標(biāo)示為安國市輝發(fā)中藥飲片加工有限公司生產(chǎn)的1批延胡索��、運(yùn)城市風(fēng)陵渡開發(fā)區(qū)華昌藥業(yè)有限公司售出的1批延胡索檢出金胺O���。
金胺O是化學(xué)染色劑,曾發(fā)現(xiàn)被用于劣質(zhì)黃柏����、蒲黃、延胡索等中藥材��、中藥飲片的非法染色��。金胺O對(duì)人體具有一定毒性作用����,被列為非食用物質(zhì)��,在中藥材�、中藥飲片和中成藥中均不得檢出����。對(duì)上述不合格藥品,相關(guān)企業(yè)和單位所在地省(區(qū))食品藥品監(jiān)管部門已依法采取了查封扣押�、暫停生產(chǎn)、要求企業(yè)召回產(chǎn)品等控制措施�。
根據(jù)通告,標(biāo)示為安徽滬昆中藥飲片有限公司生產(chǎn)的批號(hào)為130801的黃柏系從太原市長壽堂藥店有限公司小店部抽取的樣品�����,標(biāo)示為亳州市貢藥飲片廠生產(chǎn)的批號(hào)為141215的黃柏系從福建鴻越醫(yī)藥有限公司抽取的樣品����,兩家生產(chǎn)企業(yè)均否認(rèn)產(chǎn)品為本企業(yè)生產(chǎn)。
通告中提出����,請山西、福建省食品藥品監(jiān)管局徹底查清不合格產(chǎn)品來源�,請安徽省食品藥品監(jiān)管局對(duì)上述兩家企業(yè)生產(chǎn)銷售情況進(jìn)行調(diào)查核實(shí)���。請山西省食品藥品監(jiān)管局徹查運(yùn)城市風(fēng)陵渡開發(fā)區(qū)華昌藥業(yè)有限公司不合格延胡索的產(chǎn)品來源。調(diào)查處理情況于2015年11月15日前報(bào)告食品藥品監(jiān)管總局���,并及時(shí)向社會(huì)公布��。
通過此次事件����,反映出盡管當(dāng)前國家對(duì)中藥材源頭和流通的監(jiān)管更加嚴(yán)厲�����,但在中藥材市場中依然存在一些違法行為���。“整治”的不徹底��,并不能一味的把責(zé)任全追究于國家監(jiān)管部門���,我們每一位消費(fèi)者更應(yīng)該積極主動(dòng)的參與到監(jiān)督檢舉的隊(duì)伍中來���。充分行使好公民具有的權(quán)利和義務(wù)。這樣,才能確保我們的健康和利益不受侵害�����。
來源:中藥材天地網(wǎng); 鏈接:
http://www.zyctd.com/article-224503-1.html
?
2. 醫(yī)藥流通企業(yè)現(xiàn)狀與發(fā)展思考
當(dāng)前����,醫(yī)藥工業(yè)的發(fā)展趨勢是“換擋、變速���、趨緩”�;藥品招標(biāo)在各省市實(shí)施原則使藥品降價(jià)已成常態(tài)�;藥品使用終端由于“二個(gè)總量控制”與“藥占比的規(guī)定”導(dǎo)致同比增速下降;尤其是“互聯(lián)網(wǎng)+”的新模式在處方一旦放開后的發(fā)展態(tài)勢及快遞業(yè)強(qiáng)勢介入配送等原因�,將導(dǎo)致整個(gè)產(chǎn)業(yè)鏈中的流通環(huán)節(jié)生存環(huán)境嚴(yán)峻與商業(yè)模式出現(xiàn)顛覆性的變化。?我國經(jīng)濟(jì)發(fā)展方式正從規(guī)模速度型粗放增長轉(zhuǎn)向質(zhì)量效率型集約增長���,經(jīng)濟(jì)結(jié)構(gòu)正從增量擴(kuò)能為主轉(zhuǎn)向調(diào)整存量�、做優(yōu)增量并存的深度調(diào)整��,經(jīng)濟(jì)發(fā)展動(dòng)力正從傳統(tǒng)增長點(diǎn)轉(zhuǎn)向新的增長點(diǎn)����。?
目前醫(yī)藥產(chǎn)業(yè)集中度提高與行業(yè)“多����、小���、散”產(chǎn)業(yè)格局并存��。行業(yè)在通過一段時(shí)間的并購�����、重組過程之后��,一定程度上提高了產(chǎn)業(yè)集中度,尤其是藥品流通企業(yè)���,前100位的藥品批發(fā)企業(yè)已占到64.28%的市場份額��。從批發(fā)企業(yè)數(shù)量分析:2014年的法人批發(fā)企業(yè)數(shù)量與2012年相比�����,減少比率為28.63%���,短短的三年的時(shí)間����,超四分之一的藥品批發(fā)企業(yè)消失了�。


2015年上半年,雖大型藥品流通企業(yè)的主營業(yè)務(wù)收入���、利潤增長��、費(fèi)用控制普遍優(yōu)于行業(yè)整體水平�,對(duì)行業(yè)發(fā)展的引領(lǐng)作用進(jìn)一步提升�,但藥品流通行業(yè)總體銷售增長放緩、運(yùn)營成本增加����、毛利率降低等一系列現(xiàn)實(shí)情況,對(duì)全行業(yè)發(fā)展形成了較大壓力��。

上市公司共17家��,市值總值為2593億元��,平均市值為152.54億元����。規(guī)模過百億的企業(yè)有15家����,其中在800億元以上的有3家�。?
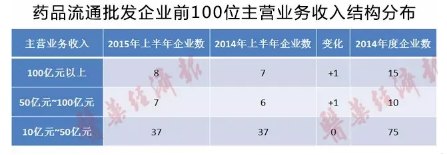
2015年上半年,醫(yī)藥電子商務(wù)繼續(xù)快速發(fā)展�。據(jù)國家食品藥品監(jiān)督管理總局統(tǒng)計(jì),2015年上半年共批準(zhǔn)�、換發(fā)證書105家,截至2015年6月30日�����,擁有互聯(lián)網(wǎng)交易資質(zhì)的企業(yè)合計(jì)為425家�,企業(yè)數(shù)量同比增長56.3%,其中B2B為90家���、B2C為319家、O2O為16家����,主要的交易模式為B2B、B2C形式����,其中B2B占銷售額比重為90%(O2O模式不含其中)�����。?
我國現(xiàn)有的醫(yī)藥產(chǎn)品的分銷模式越來越受到挑戰(zhàn)���,比如,傳統(tǒng)終端采購時(shí)間需要與商業(yè)工作時(shí)間的沖突矛盾;推廣手段與渠道單一及信息傳達(dá)不足產(chǎn)生的矛盾;市場維護(hù)與開發(fā)成本高之矛盾;人員成本越來越高與吸引高端人才能力差所發(fā)生的矛盾���。?
終端的物流成本��、回款周期與客戶信用不足等問題也是商業(yè)無法回避的問題;還有互聯(lián)網(wǎng)對(duì)傳統(tǒng)醫(yī)藥流通渠道的影響�,互聯(lián)網(wǎng)的發(fā)展解決了一個(gè)最大的問題就是“信息不對(duì)稱”�����,這對(duì)傳統(tǒng)醫(yī)藥流通影響非常大��,而且也將是趨勢�����。
未來剩下的醫(yī)藥流通可能會(huì)因?yàn)橐韵碌膬r(jià)值而存在:終端配送職能��,尤其是醫(yī)療機(jī)構(gòu)����,畢竟專業(yè)產(chǎn)品需要專業(yè)的通道����。?
人口遷移因素�����,國內(nèi)城鎮(zhèn)化率在2014年已達(dá)到54.77%��,未來可引導(dǎo)1億多農(nóng)民就近城鎮(zhèn)化落戶���,帶來新的健康醫(yī)療需求;老齡社會(huì)激活銀發(fā)市場��,利好健康產(chǎn)業(yè)的發(fā)展;新增出生人口持續(xù)增加��,促使醫(yī)療保健需求市場旺盛��。?國家持續(xù)不斷地釋放醫(yī)療服務(wù)資源��、零售藥店持續(xù)不斷地發(fā)展完善�、醫(yī)藥電子商務(wù)迅速地興起����,均為藥品流通行業(yè)提供了拓展市場的機(jī)會(huì)和動(dòng)力。?
互聯(lián)網(wǎng)技術(shù)將持續(xù)沖擊并深刻改變行業(yè)面貌�����。藥品流通行業(yè)供應(yīng)服務(wù)保障體系如何適應(yīng)未來的公共衛(wèi)生�����、計(jì)劃生育����、醫(yī)療服務(wù)、醫(yī)療保障��、健康管理等系統(tǒng)��,如何實(shí)現(xiàn)業(yè)務(wù)協(xié)同與支撐�����,并且構(gòu)建連通各級(jí)平臺(tái)和各醫(yī)療衛(wèi)生機(jī)構(gòu)的供應(yīng)信息網(wǎng)絡(luò)���。?
實(shí)行并優(yōu)化醫(yī)藥供應(yīng)鏈���,使企業(yè)盡快轉(zhuǎn)型為醫(yī)藥供應(yīng)鏈服務(wù)提供商����。當(dāng)前企業(yè)主要戰(zhàn)略整合商機(jī)在于品類采購和醫(yī)藥物流的整合��,使傳統(tǒng)分銷模式轉(zhuǎn)型升級(jí)為創(chuàng)造價(jià)值鏈的營銷模式��。所有企業(yè)應(yīng)在轉(zhuǎn)型創(chuàng)新中快速整合和優(yōu)化醫(yī)藥供應(yīng)鏈��,并與戰(zhàn)略合作伙伴及利益相關(guān)方做到無縫對(duì)接�����。?
充分利用互聯(lián)網(wǎng)技術(shù)�����,搭建醫(yī)藥電子商務(wù)平臺(tái)����,擴(kuò)展新的消費(fèi)市場。如針對(duì)慢病患者設(shè)計(jì)堅(jiān)持用藥與用藥常識(shí)咨詢服務(wù)的模塊;采用電子健康管理咨詢服務(wù)方式�,設(shè)計(jì)患者和醫(yī)療專業(yè)人員進(jìn)行實(shí)時(shí)互聯(lián)互通的服務(wù)模塊;學(xué)會(huì)使用醫(yī)藥電子商務(wù)擴(kuò)大營銷市場、擴(kuò)大對(duì)醫(yī)療機(jī)構(gòu)的服務(wù)渠道及擴(kuò)大社區(qū)藥店對(duì)慢病患者終端覆蓋的服務(wù)商機(jī)���。?
樹立服務(wù)大健康理念�,驅(qū)動(dòng)健康消費(fèi)���。圍繞大健康產(chǎn)業(yè)和消費(fèi)形態(tài)��,拓展創(chuàng)新服務(wù)產(chǎn)品及服務(wù)模式�����。開展對(duì)健康人群的服務(wù)���,并通過建立“互聯(lián)網(wǎng)+”的協(xié)作,與信息技術(shù)相結(jié)合創(chuàng)造健康組合服務(wù)產(chǎn)品���,擴(kuò)展新的消費(fèi)市場���。?
不斷推進(jìn)國際合作,創(chuàng)新醫(yī)藥供應(yīng)鏈服務(wù)模式�。有條件的企業(yè)可以與國際大健康業(yè)態(tài)有關(guān)的資本技術(shù)密集型服務(wù)企業(yè)合作,引進(jìn)先進(jìn)的健康管理技術(shù)與服務(wù)產(chǎn)品����,大膽探索引進(jìn)國際醫(yī)藥物流�、國際金融結(jié)算����、分銷零售業(yè)務(wù)等功能。?
國家對(duì)長江經(jīng)濟(jì)帶�、京津冀一體化、“一帶一路”等重大戰(zhàn)略的提出��,將進(jìn)一步帶動(dòng)國內(nèi)經(jīng)濟(jì)發(fā)展�����,并提供巨大的投資發(fā)展機(jī)遇�。對(duì)于醫(yī)藥行業(yè)來說,尤其要注意長三角地區(qū)的醫(yī)藥產(chǎn)業(yè)技術(shù)升級(jí)����、河北醫(yī)藥行業(yè)對(duì)京津產(chǎn)業(yè)轉(zhuǎn)移的承接、中醫(yī)藥服務(wù)貿(mào)易及相關(guān)產(chǎn)業(yè)對(duì)西部地區(qū)經(jīng)濟(jì)發(fā)展的拉動(dòng)等正面因素���,使企業(yè)發(fā)展戰(zhàn)略融入國家大戰(zhàn)略之中��,不斷拓展新的終端醫(yī)療消費(fèi)市場和健康服務(wù)市場���。?
來源:醫(yī)藥經(jīng)濟(jì)報(bào); 鏈接:
http://www.catcm.org.cn/newsmain.asp?id=7342&tid=&cname=
?
1. 淺談質(zhì)檢改革發(fā)展的原則與路徑
質(zhì)檢改革要遵循以下幾個(gè)原則:
一是依法依規(guī)原則��。要以法治的思維和創(chuàng)新的思維����,妥善解決改革創(chuàng)新與依法行政的沖突���。一方面要建立健全質(zhì)檢法律法規(guī),避免出現(xiàn)法律的盲區(qū)和監(jiān)管漏洞;另一方面對(duì)特定改革區(qū)域和領(lǐng)域進(jìn)行法律授權(quán)��,允許突破現(xiàn)有法律法規(guī)的改革試點(diǎn)�。
二是黨的領(lǐng)導(dǎo)原則。質(zhì)檢改革已進(jìn)入深水區(qū)���,必須要有刮骨療傷的勇氣和魄力����,否則很難打破自身利益和部門利益的藩籬�。
三是頂層設(shè)計(jì)原則?;鶎拥母母飫?chuàng)新雖然非常重要,但是必須首先得到上級(jí)的授權(quán)或認(rèn)可����,否則就會(huì)違反“法無授權(quán)不可為”的原則��。因此質(zhì)檢改革主要應(yīng)該從國家層面���、質(zhì)檢總局層面自上而下進(jìn)行。
在遵循以上原則的基礎(chǔ)上���,質(zhì)檢改革可按如下路徑逐步展開:
第一���,打造進(jìn)出口產(chǎn)品質(zhì)量安全的“宏觀監(jiān)測”機(jī)制。轉(zhuǎn)變工作思路����,從以微觀質(zhì)量檢驗(yàn)為主轉(zhuǎn)向以宏觀質(zhì)量監(jiān)測為主;從防范具體產(chǎn)品質(zhì)量安全風(fēng)險(xiǎn)為主轉(zhuǎn)向防范區(qū)域性、系統(tǒng)性產(chǎn)品質(zhì)量安全風(fēng)險(xiǎn)為主;從以執(zhí)法把關(guān)為主轉(zhuǎn)向執(zhí)法與服務(wù)并重���。大力加強(qiáng)基于大數(shù)據(jù)和云計(jì)算的進(jìn)出口產(chǎn)品�����、食品和進(jìn)出境人員以及動(dòng)植物質(zhì)量安全信息的宏觀監(jiān)測能力建設(shè)�����,通過風(fēng)險(xiǎn)分析�、風(fēng)險(xiǎn)評(píng)估和風(fēng)險(xiǎn)識(shí)別,實(shí)現(xiàn)精準(zhǔn)執(zhí)法和對(duì)重大質(zhì)量安全風(fēng)險(xiǎn)的定點(diǎn)處置�����。大力加強(qiáng)有關(guān)國內(nèi)外技術(shù)性貿(mào)易措施的跟蹤��、研究和評(píng)議隊(duì)伍建設(shè)�,建立技術(shù)性貿(mào)易措施通報(bào)、咨詢����、評(píng)議���、預(yù)警綜合信息系統(tǒng)�����,為國內(nèi)企業(yè)“走出去”戰(zhàn)略提供技術(shù)和信息支撐��。
第二�����,構(gòu)建檢管分離的質(zhì)檢工作體制�����。出口工業(yè)產(chǎn)品取消法定檢驗(yàn)以來��,一方面大量政府檢驗(yàn)檢測資源閑置浪費(fèi)無法全力參與市場競爭���,另一方面外資合資檢驗(yàn)檢測資源又大舉進(jìn)入我國市場�。根據(jù)國際慣例和市場化的發(fā)展趨勢�,檢管分離是質(zhì)檢事業(yè)健康發(fā)展的必由之路。建議將中國檢科院和各直屬檢驗(yàn)檢疫局下轄的技術(shù)中心整合重組����,組建另一個(gè)全國性的國有大型檢驗(yàn)檢測集團(tuán)公司,該公司按市場化運(yùn)作的同時(shí)��,承擔(dān)國家基準(zhǔn)實(shí)驗(yàn)室職能����。
第三、建立有利于人流物流“快進(jìn)快出”的口岸執(zhí)法體系����。一是以電子口岸建設(shè)為基礎(chǔ),建立統(tǒng)一的口岸聯(lián)檢執(zhí)法平臺(tái)。該執(zhí)法平臺(tái)應(yīng)由國家和地方口岸管理部門聯(lián)合口岸聯(lián)檢單位共同建設(shè)���,平等使用���。二是在口岸聯(lián)檢單位建設(shè)方面,近期按照“信息互換�、執(zhí)法互助、監(jiān)管互認(rèn)”的原則���,組建聯(lián)合執(zhí)法隊(duì)伍����,形成“一次申報(bào)���、一次查驗(yàn)、一次放行”的快速通關(guān)工作模式�����。遠(yuǎn)期可參照“聯(lián)合作戰(zhàn)司令部”的戰(zhàn)區(qū)模式�����,依托口岸聯(lián)檢單位現(xiàn)有資源�,組建統(tǒng)一的口岸執(zhí)法部門�����,形成海關(guān)��、檢驗(yàn)檢驗(yàn)�����、邊檢��、海事等諸兵種既專業(yè)分工又聯(lián)合作戰(zhàn)的新型口岸執(zhí)法體系�。三是按照“區(qū)港一體化”的工作思路��,將口岸查驗(yàn)工作前推后移���,充分發(fā)揮屬地和特殊監(jiān)管區(qū)檢驗(yàn)檢疫部門的工作潛力����。只要是風(fēng)險(xiǎn)可控的進(jìn)出口產(chǎn)品���,原則上均須在轄區(qū)完成檢驗(yàn)檢疫�,檢驗(yàn)檢疫結(jié)果全國通用,真正實(shí)現(xiàn)全國“通檢通放”��。
來源:凡特網(wǎng); 鏈接:
http://www.vantlab.com/html/A7848801a9d0f4f5fa31ba78af4aa9095.html
?
2. 中藥現(xiàn)代化可否走青蒿素之路�?
中國女藥學(xué)家屠呦呦因發(fā)現(xiàn)抗瘧藥物青蒿素,拯救無數(shù)生命���,與另外兩位科學(xué)家分享2015年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)�,引發(fā)社會(huì)各界關(guān)注���。?
2011年獲得美國拉斯克醫(yī)學(xué)獎(jiǎng)時(shí)��,屠呦呦的獲獎(jiǎng)感言是��,“這是中醫(yī)中藥走向世界的一項(xiàng)榮譽(yù)”�����。此次獲得諾貝爾獎(jiǎng)��,屠呦呦說:“青蒿素是傳統(tǒng)中醫(yī)藥送給世界人民的禮物。青蒿素的發(fā)現(xiàn)是集體發(fā)掘中藥的成功范例����。”?
中國藥科大學(xué)副校長、教育部長江學(xué)者特聘教授孔令義認(rèn)為��,青蒿素是天然藥物�,來源于中草藥,而后來廣泛應(yīng)用的抗瘧效果更好的青蒿素衍生物���,則是結(jié)構(gòu)修飾的產(chǎn)物�,是化學(xué)藥物即西藥��。其實(shí)��,將化學(xué)藥物和中藥對(duì)立起來沒有意義�����。復(fù)旦大學(xué)藥學(xué)院教授陳道峰也認(rèn)為�����,青蒿素的發(fā)現(xiàn)�����,其實(shí)是中藥材的科學(xué)化研究��,或者說是植物藥的科學(xué)化研究,這是中藥現(xiàn)代化的道路之一�。?
近年來,中藥引起西方一些國家的重視�����,以植物藥為例����,西方有40家植物研究機(jī)構(gòu),500多個(gè)研究項(xiàng)目����。在日本,許多漢方藥企建立的研究機(jī)構(gòu)從事漢方藥物研究����,建立了藥材生產(chǎn)基地。美國NIH和艾滋病防治中心分別對(duì)300多種中草藥進(jìn)行篩選和有效成分研究��,從植物藥中尋找抗癌活性成本�。?
而國家食藥監(jiān)總局藥品審評(píng)中心發(fā)布的《2014年度藥品審評(píng)報(bào)告》顯示,2014年149個(gè)獲批上市的新藥中��,中藥有11個(gè)���,占比只有7.38%����。?
來源:中國中藥協(xié)會(huì); 鏈接:
http://www.catcm.org.cn/newsmain.asp?id=7313&tid=&cname=
?
1. 中藥飲片標(biāo)準(zhǔn)規(guī)范長路漫漫
目前�����,中藥飲片主要執(zhí)行國家標(biāo)準(zhǔn)與地方標(biāo)準(zhǔn)����。全國生產(chǎn)的中藥飲片已經(jīng)超過2000種,而現(xiàn)行的2010版《中國藥典》共收載的中藥飲片質(zhì)量標(biāo)準(zhǔn)僅800多種�����,其他品種的生產(chǎn)只能執(zhí)行省����、自治區(qū)、直轄市人民政府藥品監(jiān)督管理部門制定的炮制規(guī)范����。甚至有的飲片生產(chǎn)企業(yè)加工的飲片在國家標(biāo)準(zhǔn)和省級(jí)地方標(biāo)準(zhǔn)中都沒有收載,也就是說根本沒有檢驗(yàn)依據(jù)����,質(zhì)量無法把控�。
硫磺熏蒸是傳統(tǒng)的中藥材保存技法��,目的是為防蟲���、防霉和殺菌��。但中藥材經(jīng)過熏硫之后����,不僅顏色好看還可增加重量���。有媒體報(bào)道�,50公斤百合熏硫后可以增加到60公斤����。而國家規(guī)定,每公斤百合熏硫的硫磺含量不能超過150毫克�����。顯然有許多企業(yè)達(dá)不到要求��。事實(shí)上,一些中藥材經(jīng)過熏蒸后�����,硫磺含量超過國家規(guī)定幾百倍��。
長期以來��,我國中藥飲片執(zhí)行的《中國藥典》�、《全國中藥飲片炮制規(guī)范》����、《各省市中藥飲片炮制規(guī)范》三級(jí)標(biāo)準(zhǔn),但標(biāo)準(zhǔn)之間并不完全統(tǒng)一�����,國家標(biāo)準(zhǔn)與地方標(biāo)準(zhǔn)之間��、地方標(biāo)準(zhǔn)與地方標(biāo)準(zhǔn)之間在基源�����、名稱(俗名�����、地方習(xí)慣用名的存在使得同名異物現(xiàn)象很多)、炮制規(guī)格及炮制方法等方面差別甚大����,相同藥材經(jīng)常出現(xiàn)多種炮制方法,在生產(chǎn)�、經(jīng)營、使用�����、檢驗(yàn)上沒有明確規(guī)定�����,操作性不強(qiáng)�����。
有媒體報(bào)道�����,根據(jù)《藥品生產(chǎn)質(zhì)量管理規(guī)范2010年版》認(rèn)證要求,中藥飲片生產(chǎn)企業(yè)要在2015年12月31日前���,必須通過國家新版GMP認(rèn)證�,否則不得繼續(xù)生產(chǎn)��。根據(jù)國家食品藥品監(jiān)督管理總局的統(tǒng)計(jì)數(shù)據(jù)��,截至2013年12月�����,我國取得中藥飲片GMP資格認(rèn)證的企業(yè)有1580家���。而由于質(zhì)量問題頻發(fā),不少企業(yè)被收回了GMP證書��。
中藥材種植規(guī)范化難度很大��,小作坊式種植生產(chǎn)��、同一藥材多地收購的現(xiàn)象普遍存在����,每個(gè)品種短時(shí)間內(nèi)無法達(dá)成規(guī)范化規(guī)模化種植,質(zhì)量差異大���。中藥飲片的基源復(fù)雜�,中藥材同品種多產(chǎn)地的情況普遍����,導(dǎo)致中藥材的顯微特征、性狀����、藥性有差異。中藥材����、中藥飲片的質(zhì)量均勻性差,不同產(chǎn)地���、不同來源質(zhì)量差異較大����。因此要完全弄清各種藥材或中藥飲片的成分和療效�����,制訂統(tǒng)一的中藥飲片質(zhì)量標(biāo)準(zhǔn)不是一朝一夕的事情。
基于中藥飲片這一類藥品的特殊性���,針對(duì)目前全國中藥飲片質(zhì)量標(biāo)準(zhǔn)存在的部分品種質(zhì)量標(biāo)準(zhǔn)科學(xué)適用性不強(qiáng)���,中藥飲片質(zhì)量標(biāo)準(zhǔn)不完善,許多常規(guī)習(xí)用品種無標(biāo)準(zhǔn)可執(zhí)行等問題�,國家藥監(jiān)部門可建立省級(jí)中藥飲片企業(yè)標(biāo)準(zhǔn)備案機(jī)制。
在進(jìn)行充分的試驗(yàn)研究和數(shù)據(jù)收集的基礎(chǔ)上����,企業(yè)可針對(duì)市場需求大但無標(biāo)準(zhǔn)可執(zhí)行或國家標(biāo)準(zhǔn)制訂不合理的中藥飲片,制訂中藥飲片企業(yè)標(biāo)準(zhǔn)�,向所在地的省級(jí)藥監(jiān)部門進(jìn)行中藥飲片企業(yè)標(biāo)準(zhǔn)備案�,一并提供研究資料來佐證企業(yè)標(biāo)準(zhǔn)制訂的合理性和科學(xué)性;省級(jí)藥監(jiān)部門在受理后進(jìn)行形式審查����、專家評(píng)審和核查,對(duì)符合要求的企業(yè)標(biāo)準(zhǔn)準(zhǔn)予備案并下發(fā)備案的中藥飲片企業(yè)標(biāo)準(zhǔn)�,并進(jìn)行公示。
同時(shí)����,實(shí)行國家標(biāo)準(zhǔn)與注冊標(biāo)準(zhǔn)相結(jié)合的辦法,建議藥監(jiān)部門制訂中藥飲片注冊制度和相關(guān)指導(dǎo)原則,保障該注冊標(biāo)準(zhǔn)的落地實(shí)行��。協(xié)會(huì)可以組織制定相關(guān)標(biāo)準(zhǔn)在協(xié)會(huì)內(nèi)部推薦實(shí)行��,企業(yè)也可根據(jù)自身的實(shí)際情況以及研究的數(shù)據(jù)���,制定出高于國家標(biāo)準(zhǔn)的“內(nèi)控標(biāo)準(zhǔn)”來進(jìn)行注冊申請�����。這樣可以促進(jìn)中藥飲片質(zhì)量標(biāo)準(zhǔn)的完善和提高����,企業(yè)注冊標(biāo)準(zhǔn)的申請和執(zhí)行也對(duì)國家標(biāo)準(zhǔn)的完善具有很好的指導(dǎo)作用��。
針對(duì)不同中藥飲片的質(zhì)量標(biāo)準(zhǔn)或標(biāo)準(zhǔn)的各項(xiàng)具體質(zhì)量指標(biāo)��,采取漸進(jìn)的方式��,成熟一項(xiàng)����,制定一項(xiàng),執(zhí)行一項(xiàng)�����。從而使得我國中藥飲片加工企業(yè)、醫(yī)療機(jī)構(gòu)����、零售藥店等能夠按規(guī)范統(tǒng)一的標(biāo)準(zhǔn)實(shí)施,從而確保中藥飲片質(zhì)量合格有效�����,發(fā)揮出中藥應(yīng)有的治療效果��。
來源:中藥材天地網(wǎng); 鏈接:
http://www.zyctd.com/article-224669-1.html ?